Covid-19, N-Acetilcisteína y Readaptación Física Post-Infección: Parte 1
Publicado 23 de marzo de 2021, 8:18
Autor: Juan Pablo Murillo
(Practicante Pregrado Cultura Física, Deporte y Recreación - Universidad Santo Tomás, Colombia)
Revisor: Prof. Camila Gho (Chile)
Editor: Prof. Diego A. Bonilla (Colombia)
Debido a la pandemia por SARS-CoV-2 se han llevado a cabo diversos ensayos clínicos para evaluar el potencial de diferentes sustancias para reducir síntomas, prevenir la infección y disminuir la tasa de mortalidad. Dentro de las diferentees opciones evaluadas se encuentra la N-Acetilcisteína (NAC), ya que al parecer sus propiedades antioxidantes y antiinflamatorias podrían resultar beneficiosas para combatir el virus - no solo como tratamiento sino también como agente terapéutico preventivo. En esta serie de entradas se describirá el mecanismo de acción del SARS-CoV-2 y, posteriormente, se discutirá el posible mecanismo de acción del NAC, los efectos reportados al día de hoy, su interacción con el virus y el rol que podría tener en el proceso de readaptación física en pacientes post-infección. En este sentido, esta primera parte se centra en entender cómo actúa el virus en nuestro organismo para poder comprender las razones por las cuales el NAC ha sido postulado como un tratamiento.
Coronavirus (Orthocoronavirinae) es una subfamilia de virus de ARN cuyos registros datan desde el siglo IX antes de cristo. Aunque el coronavirus existe en huéspedes animales, en 2019 la variante SARS-CoV-2 atravesó la barrera entre especies y dio lugar al contagio en seres humanos en Wuhan - China(Poland, Ovsyannikova, & Kennedy, 2020). Un grupo de pacientes ingresó con fiebre, tos, dificultad para respirar y otros síntomas. La evaluación por tomografía axial computarizada reveló opacidades variadas en los pulmones, acercándolos a un diagnóstico inicial de neumonía con causa desconocida (Udugama et al., 2020). En consecuencia, se tomaron muestras biológicas y se logró identificar y aislar rápidamente el SARS-CoV-2 como patógeno. Su nombre precisamente hace referencia al síndrome respiratorio agudo severo que genera. El virus presenta una alta capacidad para replicarse en células epiteliales y neumocitos de la vía respiratoria inferior (Chen et al., 2021).
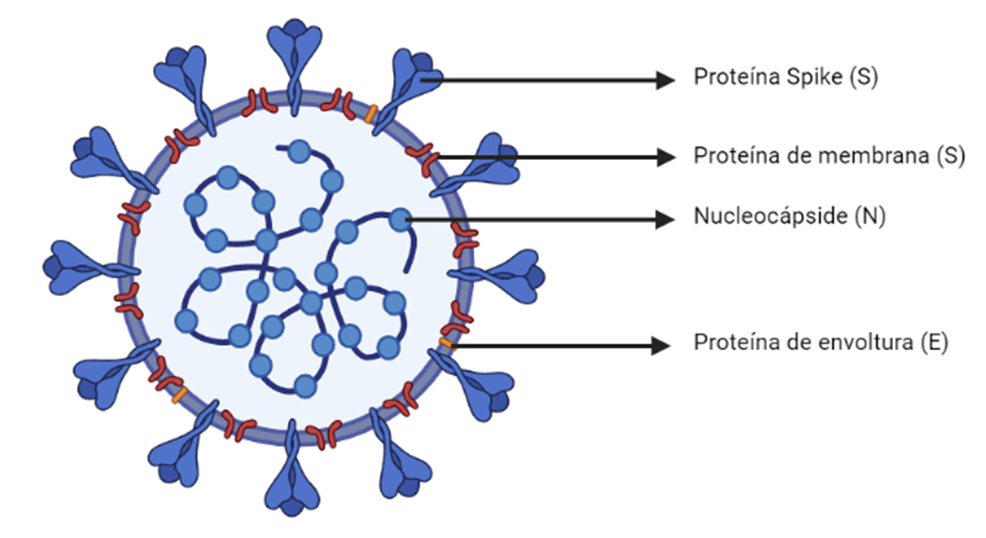
Figura 1. Morfología del SARS-CoV-2. Autoría propia. Creada con BioRender.com
Debemos entender que este patógeno se transmite a través del contacto con fluidos de personas contagiadas (e.g., gotículas generadas al toser o estornudar). Los estudios han identificado que el receptor de la enzima convertidora de angiotensina 2 (ACE2) actúa como la vía a través del cual el virus entra a la mucosa respiratoria (Singhal, 2020). De hecho, el SARS-CoV-2 se une al receptor ACE2 por medio de las glucoproteínas Spike, lo cual respalda la especificidad hacia tejidos particulares en sujetos infectados, puesto que este receptor se expresa en el tracto respiratorio bajo, corazón, riñón, estómago, vejiga, esófago e intestino (Guo et al., 2020; Pastrian-Soto, 2020).
La glucoproteína Spike del SARS-CoV-2 contiene dos subunidades denominadas S1 y S2, de las cuales S1 determina el rango virus-huésped (además del tropismo celular con el dominio de función clave) mientras que S2 media la fusión de la membrana virus-célula. Así que tras la unión de las proteínas Spike con ACE2, y una vez completada la fusión de la membrana, el ARN viral se libera directamente al citoplasma de las células para ser traducido en dos proteínas, las cuales codifican proteínas no estructurales y forman el complejo RTC. Este replica y sintetiza un grupo de ARN subgenómico que finalmente se traduce como proteínas de la nucleocápside y las glucoproteínas de la envoltura, formando brotes de partículas virales. Finalmente, las vesículas que contienen los viriones se terminan fusionando con la membrana plasmática para liberar el virus, continuando la infección y, en consecuencia, las afectaciones al huésped (Guo et al., 2020).
Teniendo en cuenta lo anterior, se puede justificar la sintomatología mostrada en los pacientes contagiados, pues ACE2 pertenece al sistema renina-angiotensina-aldosterona, el cual tiene acción permisiva y potenciadora del sistema nervioso simpático, causando vasoconstricción, aumento en la presión arterial y promoviendo procesos de inflamación (Bevacqua & Perrone, 2020). Además, con la respuesta inmune del organismo frente a SARS-CoV-2, se provoca algo denominado "tormenta de citocinas", que básicamente hace referencia a procesos pro-inflamatorios que pueden afectar el tejido pulmonar (Lozada & Núñez, 2020). En cuanto a la afección en otros órganos, la evidencia señala que el COVID-19 puede ser multisistémico. Por ejemplo, algunos de los pacientes han desarrollado afectaciones cardiacas, en donde la inflamación severa y repentina del músculo cardiaco causa arritmias y perjudica el bombeo eficiente de sangre, por lo que usuarios con algún historial de enfermedades cardiovasculares tienen un riesgo más elevado de mortalidad en comparación con individuos aparentemente sanos (Esakandari et al., 2020). Por otr lado, la deficiencia de oxígeno conlleva a efectos negativos a nivel vascular en los pulmones, los revestimientos del corazón y los vasos sanguíneos en general, lo cual aumenta el riesgo de desarrollar obstrucciones vasculares, coagulación anormal en la sangre y tromboembolismos venosos. El ambiente pro-inflamatorio de la "tormenta de citocinas" empeora dichas complicaciones, razón por la cual se usan inhibidores de ciertas citocinas para reducir la severidad de la enfermedad (Esakandari et al., 2020).
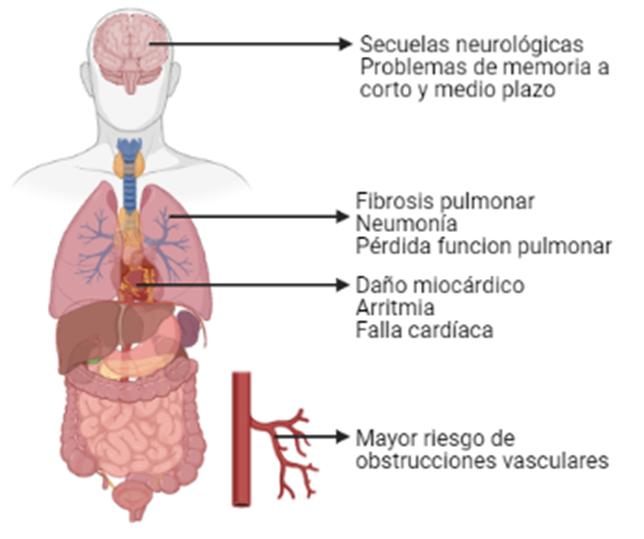
Figura 2. Efectos tras el contagio por COVID-19. Autoría propia. Creada con BioRender.com
En resumen, las vías respiratorias superiores e inferiores son las principales vías de entrada del virus al cuerpo. Esto implica una mayor probabilidad de sufrir neumonía (en los casos más comunes) aunque se puede llegar a desencadenar fibrosis pulmonar y pérdida de la funcionalidad del tejido pulmonar, lo cual afectada seriamente la calidad de vida. Además, se ha aumentado el número de reportes de pacientes infectados por SARS-CoV-2 que muestran deterioro en el sistema nervioso central y periférico, lo cual causa un daño directo a las neuronas y lleva también a secuelas neurológicas (Wang, Kream, & Stefano, 2020). Finalemente, se han reportado efectos perjudiciales en el sistema cardiovascular. Las lesiones más comunes son arritmias, miocarditis, shock cardiogénico o incluso falla cardiaca, lo cual aumenta la preocupación en aquellos pacientes con un historial de afectaciones al sistema cardiorrespiratorio (Pollard, Morran, & Nestor-Kalinoski, 2020).
Una vez entendido el mecanismo de acción general del virus SARS-CoV-2, sus efectos más comunes en el cuerpo humano y algunas de las secuelas más relevantes que se presentan tras su infección, en la próxima entrada abordaremos el potencial de acción del NAC y los efectos que han sido reportados en diferentes estudios que buscan combatir o prevenir la sintomatología en pacientes infectados.
Powered by:
Exercise & Research Division
Dynamical Business & Science Society - DBSS International SAS
Referencias
Bevacqua, R. J., & Perrone, S. V. (2020). COVID-19: relación entre enzima convertidora de angiotensina 2, sistema cardiovascular y respuesta inmune del huésped Insuficiencia Cardíaca, 15(2), 18.
Chen, Y., Klein, S. L., Garibaldi, B. T., Li, H., Wu, C., Osevala, N. M., . . . Leng, S. X. (2021). Aging in COVID-19: Vulnerability, immunity and intervention. Ageing Research Reviews, 65. doi:10.1016/j.arr.2020.101205
Esakandari, H., Nabi-Afjadi, M., Fakkari-Afjadi, J., Farahmandian, N., Miresmaeili, S.-M., & Bahreini, E. (2020). A comprehensive review of COVID-19 characteristics. Biological Procedures Online, 22(1). doi:10.1186/s12575-020-00128-2
Guo, Y.-R., Cao, Q.-D., Hong, Z.-S., Tan, Y.-Y., Chen, S.-D., Jin, H.-J., . . . Yan, Y. (2020). The origin, transmission and clinical therapies on coronavirus disease 2019 (COVID-19) outbreak – an update on the status. Military Medical Research, 7(1). doi:10.1186/s40779-020-00240-0
Lozada, I., & Núñez, C. (2020). COVID-19: respuesta inmune y perspectivas terapéuticas. Revista Peruana de Medicina Experimental y Salud Pública, 37(2), 312-319. doi:10.17843/rpmesp.2020.372.5490
Pastrian-Soto, G. (2020). Bases Genéticas y Moleculares del COVID-19 (SARS-CoV-2). Mecanismos de Patogénesis y de Respuesta Inmune. International journal of odontostomatology, 14(3), 331-337. doi:10.4067/s0718-381x2020000300331
Poland, G. A., Ovsyannikova, I. G., & Kennedy, R. B. (2020). SARS-CoV-2 immunity: review and applications to phase 3 vaccine candidates. The Lancet, 396(10262), 1595-1606. doi:10.1016/s0140-6736(20)32137-1
Pollard, C. A., Morran, M. P., & Nestor-Kalinoski, A. L. (2020). The COVID-19 pandemic: a global health crisis. Physiological Genomics, 52(11), 549-557. doi:10.1152/physiolgenomics.00089.2020
Singhal, T. (2020). A Review of Coronavirus Disease-2019 (COVID-19). The Indian Journal of Pediatrics, 87(4), 281-286. doi:10.1007/s12098-020-03263-6
Udugama, B., Kadhiresan, P., Kozlowski, H. N., Malekjahani, A., Osborne, M., Li, V. Y. C., . . . Chan, W. C. W. (2020). Diagnosing COVID-19: The Disease and Tools for Detection. ACS Nano, 14(4), 3822-3835. doi:10.1021/acsnano.0c02624
Wang, F., Kream, R. M., & Stefano, G. B. (2020). Long-Term Respiratory and Neurological Sequelae of COVID-19. Medical Science Monitor, 26. doi:10.12659/msm.92899
